꿀풀 및 섬초롱꽃의 생육과 항산화활성에 미치는 질소시비의 영향
Effect of Nitrogen Fertilizer on the Growth and Antioxidant Activities of Prunella vulgaris and Campanula takesimana
Article information
Abstract
This research was conducted to identify the effect of nitrogen form on the growth and antioxidant activities of native plants. Prunella vulgaris and Campanula takesimana were cultivated with a ebb and flow hydroponic system and treated with 3 nitrogen forms of nutrient solution of NO3-N, NH4-N, and mixed NO3/NH4-N. The growth of Prunella vulgaris and Campanula takesimana showed the best results in nutrient solution of NO3/NH4-N. Suppling the NO3/NH4-N fertilizer increased the contents of the total flavonoids in Prunella vulgaris. Total polyphenol content and DPPH scavenging activity, and NO scavenging activity were higher in NH4-N treatment, while suppling NO3-N decreased the contents of total flavonoids and total polyphenol, and the antioxidant activities of DPPH scavenging activity and NO scavenging activity.
I. 서론
자생 식물은 약용식물로서의 가치를 이용한 각종 의학용 소재 또는 한방 기능성 화장품과 같은 산업적 원료로서 많은 연구가 이 루어졌으며, 아울러 봄철에 산나물로 이용되었던 민간 기록에 근거 하여 재배 연구가 진행되었으나(Lee, 1985), 현재 대표적인 쌈 재 료로 사용되는 곰취, 곤달비 그리고 산마늘 등을 제외하고는 대부 분 봄철에 한정되어 공급되고 있다(Park et al., 1993). 조경용 소재 분야에서도 자생식물을 활용하는 사례가 늘고 있는데, 자생식물들 은 우리나라의 기후 환경에 가장 잘 적응한 식물체로써 도입 식물 에 비하여 내성이 강하므로 활용가치가 높다(Song et al., 2001).
이와 같이 자생식물의 이용성과 수요는 다양한 분야에서 증가하 는 추세를 보이는 반면 재배 및 고기능성 관련 연구는 미흡한 실정 이다. 특히 최근 국민소득의 증대, 생활패턴의 서구화 그리고 식생 활 변화로 각종 암, 성인병과 만성퇴행성 질병 발병률 증가 및 기능 성 건강식품에 대한 수요증가에 따라(Kim et al., 2008; Lim et al., 1996; Lim et al., 2008; Moon et al., 2003; Oh and Kim, 2006) 집약적 재배로의 전환이 진행되고 있다. 그러나 자생식물에 대한 시비 관련 연구(Jeong et al., 2012; Lee et al., 2007; Lee et al., 2008)와 생산성 연구(Nam et al., 2009) 등을 보면 질산태 질소와 암모니아태 질소에 대한 선호도 특성이나 내적 품질 변화에 대한 연구, 특히 항산화 활성 및 기능성 물질에 대한 연구는 많지 않다 (Abbes et al., 1995; Bar-Tal et al., 2001).
꿀풀(Prunella vulgaris)은 하고초로도 불리는데, 청열, 해독, 지통의 효능이 있고, 인후염과 두통을 치료하는데 사용하며, 간손 상 치료효능, 갑상선기능 항진증, 고혈압에 대한 효과와 항산화 및 항균활성에 대한 보고(Moon et al., 2007) 등이 밝혀져 있다. 섬초 롱꽃(Campanula takesimana)은 절화 및 분화용으로 개발가치가 높고, 한방과 민간에서는 뿌리를 천식, 보익, 경풍, 한열, 편도선염, 인후염 등의 치료약재로 사용하며, 어린 순과 잎은 나물용 및 쌈용 으로 이용된다(Kim et al., 2012). 따라서 본 연구에서는 기능성뿐 만 아니라 경관소재로서의 고부가가치를 인정받고 있는 꿀풀과 섬 초롱꽃을 대상으로 질산태 질소와 암모늄태 질소 시비가 생육 및 항산화 활성에 미치는 영향을 조사하였다.
II. 연구방법
공시 재료는 꿀풀(Prunella vulgaris)과 섬초롱꽃(Campanula takesimana)을 사용하였으며, 본엽이 3-4매 전개된 유묘를 자생 식물 재배농장으로부터 구입하여 이용하였다. 2012년 3월 펄라이 트(파라트, 삼손주식회사) 배지를 사용하여 직경 13cm의 실험용 포트에 정식한 후 플라스틱 온실 내에서 ebb and flow 수경재배 시 스템을 이용하여 오전 10시부터 오후 4시까지 시간당 10분간 배양 액을 순환시켜 재배하였다. 배양액 처리는 Hoagland 양액을 변형 하여 질산태 질소(NO3-N)처리구, 암모늄태 질소(NH4-N)처리구 및 혼용처리구(NO3-N+NH4-N) 등 3처리구로 구분하였다(Lee et al, 1997). NO3-N 처리구는 1mM KH2PO4, 2mM K2SO4, 5mM Ca(NO3)2, 2mM MgSO4, 5mM KCl, 25μM H3BO3, 4μM ZnSO4․7H2O, 0.5μM CuSO4․5H2O, 0.05μM H2MoO4H2O, 2μ M MnCl2․4H2O, 15μM Fe-EDTA로 조성하였다. NH4-N 처리구 는 Ca(NO3)2를 5mM CaCl2와 10mM NH4H2PO4로 대체, 조성하 였다. NO3-N과 NH4-N 혼용처리구는 2.5mM Ca(NO3)2와 5mM NH4H2PO4 농도로 질소공급원을 혼합하였다. 이외의 배양액 조성 은 동일하게 처리하였으며, pH는 5.0-6.0으로, 처리구당 5개의 포 트를 1반복으로 3반복 처리하였다. 재배 95일 후 2012년 6월 수확 하여 생육조사를 실시하였고, 분석시료를 채취하였다.
엽록소 측정은 수확 시 3-4엽 부위에서 생체 2g을 채취하여 메탄 올에 담가 균질화한 후 밀봉한 것을 하루 이상 냉장 보관하였고, 추 출된 여액을 필터링하여 흡광광도계를 이용하여 664nm와 645nm 에서 흡광도를 측정하여 환산하였다(William and Paul, 1985).
총플라보노이드 함량은 Hyun et al.(2011)의 방법을 변형하여 적용하였다. 수확시 채취한 잎과 뿌리 생체시료 2g을 99% 메탄올 에 담가 균질화 한 후 필터링하여 Dimethylsulfoxide (DMSO)에 녹인 후 0.5mL을 취하여 10% 에탄올 1.5mL, ammonium nitrate 0.1mL, 1M potassium acetate 0.1mL 그리고 증류수 2.8mL을 혼 합 후 충분히 교반하고, 이후 40분간 실온에 정치시킨 후 상등액을 415nm에서 흡광도를 측정하였다. 10% ammonium nitrate 용액 대신 증류수를 가한 것을 이용해 시료구의 흡광도를 뺀 값을 구하 여 총 플라보노이드 함량을 구하였다. 표준선은 quercetin을 이용 하였으며 QE(quercetin equivalents)·g-1로 나타내었다.
Total polyphenol 함량은 Folin-Denis법(Singleton and Rossi, 1965)으로 비색 정량하였다. 수확시 채취한 잎과 뿌리 생체 시료 2g을 99% 메탄올에 담가 균질화 한 것을 필터링하여 DMSO 에 녹인 후 0.2mL을 취한 후 증류수를 가하여 2mL이 되게 한다. 이 것에 Folin-Ciocalteu’s phenol regent를 0.2mL 첨가하여 4mL로 만든 다음 1시간동안 실온, 암기에 두었다. 흡광광도계를 이용하여 흡광도 725nm에서 흡광도를 측정하였으며, tannic acid를 표준품 으로 적용하여 TAE (tannic acid equivalent)·g-1로 총폴리페놀함 량을 표시하였다.
1,1-diphenyl-2-picrylhydrazyl(DPPH) radical 소거활성은 수확시 채취한 잎과 뿌리 생체시료 2g을 사용하여 Repe et al.(2006) 의 방법을 변형하여 적용하였다. Positive control로 butylated hydroxyanisole(BHA)와 α-tocopherol을 사용하였다. 99% 에탄 올에 용해된 DPPH (Sigma-Aldrich Co.)에 수집된 생체 시료를 넣어 진탕한 후 30분간의 반응시간을 두고 흡광광도계 525nm 에 서 흡광도를 측정하였고, 시료첨가구와 비첨가구 사이의 흡광도 차 이를 백분율로 표시하였다. Nitric oxide(NO) 소거활성은 Kang (2011)의 방법을 변형하여 측정하였다. 추출물 시료 50 μl에 100μ M NaNO2 100μl를 가하여 37°C의 암소에서 1시간 반응시킨 후 5% H3PO4로 희석한 1% sulfanilamide를 첨가하여 암소에서 5분 간 반응시켰다. 이후 0.1% N-1- naphthylethyene- diamine dihydrochloride(NED) 50μl를 첨가하고 10분 후 microplate reader(Triad LT; Dynex Technologies Inc., Chantilly, VA, USA)를 이용하여 550nm에서 흡광도를 측정하였다. NO 소거능 은 시료 비첨가구의 흡광도에 대한 시료 첨가구의 흡광도차이를 백 분율(%)로 환산하여 나타내었다.
III. 결과 및 고찰
질소는 식물의 생장과 발달에 중요한 역할을 담당하는 무기원소 로 근계에서 흡수되어 단백질, 핵산, 엽록소 및 생장조절물질 등의 질소화합물의 합성에 이용된다(Below, 2002). 질소원의 형태를 NO3-N과 NH4-N 처리구 및 혼용구로 처리한 결과, NO3-N와 NH4-N 혼합처리구의 생육이 가장 좋았다(Table 1). 초장, 엽장, 엽 폭, 엽수는 꿀풀과 섬초롱꽃 모두 혼합처리구에서 가장 좋았고, NO3-N처리구, NH4-N처리구의 순서로 감소하였다. 엽록소의 함 량은 꿀풀의 경우 NO3-N와 NH4-N 혼합처리구가 높았으며(Table 2), 질소원별로는 NO3-N 처리구에 비해 NH4-N처리구의 엽록소 함량이 다소 높게 나타났다. 섬초롱꽃의 엽록소함량은 NO3-N 처 리구에서 다소 높은 경향을 나타내었으나 유의적인 차이는 보이지 않았다. 일반적으로 양액 조성의 경우 NO3-N과 NH4-N을 혼용하 여 공급하는데, NO3-N은 pH를 높이고 NH4-N은 pH를 낮춘다 (Martin et al., 1977). NH4 +의 공급량이 증가할 경우 SO4 -, PO4 -의 흡수를 증가시키고 H+를 많이 방출시키므로 pH가 낮아지고, NO3 - 의 사용을 늘릴 경우 Ca+, Mg+ 등의 흡수를 증가시키고, OH-를 방 출하므로 pH가 높아진다(Lee et al., 2003). 토마토의 경우 주로 뿌 리에서 수소이온과 함께 흡수되는 질산태 질소를 선호하기 때문에 재배 이후 토양 pH가 증가하는 경향을 보였다(Kang et al., 2010). 이러한 pH의 영향을 고려할 때 본 실험에서도 NO3-N와 NH4-N 혼 합처리구에서 생육이 양호했던 것으로 볼 수 있겠으나 한편 식물 체의 동화과정 측면에서 질소질 비료원으로 NO3-N 보다는 NH4-N이 더 우수하다는 연구(Sylvia et al., 2005; Jeong and Kim, 1998)와 원예작물의 경우 NO3-N 형태의 비료 공급이 NH4-N 형태로 공급하는 것보다 생산량을 증가시킨다는 보고 (Abbes et al., 1995; Bar-Tal et al., 2001) 등을 고찰할 때 식물의 종류에 따라 선호하는 질소의 형태가 다양함을 알 수 있다. 또한 토 양중의 암모늄태 질소는 질산화과정을 거쳐 질산태 질소로 변하기 쉽기 때문에 암모늄태 질소와 질산태 질소 중 어느 것이 더 많이 식 물체내로 흡수되는지 비교하기는 어렵다고 밝힌 Jin et al.(2003) 은 고농도의 질산태 질소를 시용하였을 때에는 지하부의 질산 환원 시스템이 포화되어 환원되지 않은 질산이 지상부로 이동하고 질산 환원효소의 활성이 유도된다고 밝힌 바 있다.
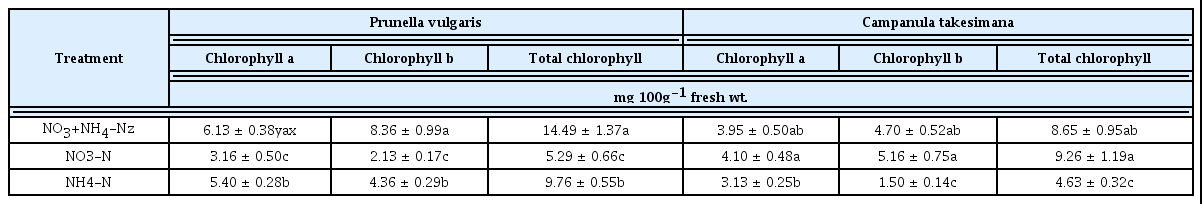
Effect of nitrogen form on the chlorophyll a, b, and total contents of Prunella vulgaris and Campanula takesimana.
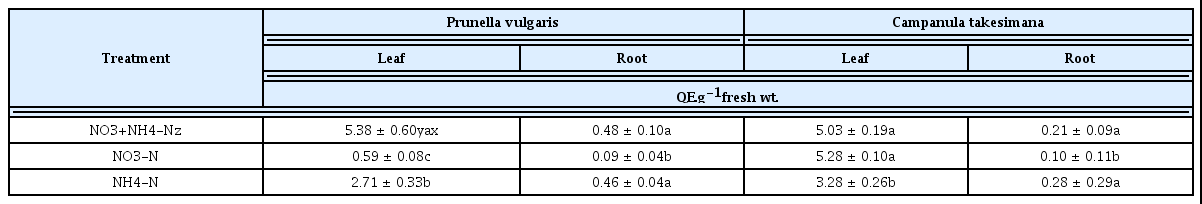
자생식물은 산채 또는 약용자원으로 이용되기 위한 목적으로 재 배되는 경우가 많은데 시비 형태에 따른 체내 기능성 물질의 함량 을 총 플라보노이드 함량과 총 폴리페놀 함량을 통해 알아보았다 (Table 3, 4). 총 플라보노이드 함량은 꿀풀의 잎과 뿌리 모두 NO3-N와 NH4-N 혼합처리구에서 높은 함량을 나타냈고, NO3-N 처리구에서 낮았다(Table 3). 섬초롱꽃은 잎의 총 플라보노이드 함 량은 NO3-N처리구에서 대조구보다 약간 증가하는 경향이었으나 뿌리는 NH4-N 처리구에서 높았다. 이것은 플라보노이드가 항산 화성을 가지는 물질이며, NH4-N의 공급이 증가하면 뿌리에 축적 되거나 독성 피해가 발생하기 때문에 이에 따른 독성 문제를 해소 하기 위해 뿌리에서 적극 합성되거나 다른 기관으로부터 전류되는 것으로 생각된다(Britto and Kronzucker, 2002; Yi et al., 2013).
총 폴리페놀 함량은 총 플라보노이드와 함께 체내 기능성 물질 의 함량을 나타내는 지표로 사용되는데, 자생식물에 있어 페놀성 화합물은 고유한 맛을 나타내는 성분으로(Kim et al., 1999), 식물 성 페놀 화합물은 단순한 페놀류에서 페놀산류, 페닐프로파노이드 류, 그리고 플라보노이드를 포함하며, 항균, 항알러지, 항산화, 항 암, 심장질환 그리고 당뇨병 예방 등에 효과가 있는 것으로 보고되 었다(Azuma et al., 1999). 꿀풀과 섬초롱꽃의 지상부의 총 폴리페 놀 함량은 NH4-N처리구가 다소 높은 경향을 나타내었으나 대조구 와 유의적인 차이는 나타나지 않았고, 꿀풀의 경우 NO3-N을 처리 하였을 때 매우 낮은 값을 보였다(Table 4). 꿀풀과 섬초롱꽃의 뿌 리에서의 총 폴리페놀 함량은 NH4-N 처리구에서 증가하는 경향을 나타내어 암모늄태 질소의 공급이 뿌리의 항산화 물질의 증가를 초 래하는 것으로 나타났다. 이는 앞서 나타난 뿌리 주위에서 발생하 는 독성효과 이외에 식물체내에서 유기질소로 환원되는 과정에서 NH4-N의 에너지 소비량이 적기 때문에(Sylvia et al., 2005; Jeong and Kim, 1998) 좀 더 많은 기능성 물질을 생산하였던 것으 로 생각된다. 꿀풀의 경우 총 폴리페놀과 총 플라보노이드 함량이 NO3-N을 처리할 경우 감소하는 경향을 보였는데, Liu et al.(2010)은 질소시비량이 증가할 때 총 플라보노이드함량과 항산 화활성이 감소한다고 보고한 바 있다. L-phenylalanine은 플라보 노이드 및 폴리페놀 생합성에 이용되는 초기물질이자 또한 단백질 합성의 전구물질로 이용되기 때문에 전구물질에 대한 페놀성 화합 물과 단백질 합성간의 경쟁이 일어나게 되며, 질소시비량이 많을수 록 단백질 합성이 촉진되어 플라보노이드 합성이 억제되고, 질소 결핍 시 오히려 페닐알라닌의 탈아민화를 촉진하여 플라보노이드 가 합성된다고 하였다. 이러한 결과를 고려할 때 꿀풀은 NO3-N처 리에 의해 오히려 단백질 대사가 활성화되었을 가능성도 생각해 볼 수 있겠다.
DPPH는 항산화제나 항산화 활성을 나타내는 페놀성 물질에 의 해 수소(전자)를 공여함으로써 라디칼의 색이 탈색되는 현상을 나 타낸다(Blois, 1958). DPPH 라디칼 소거능을 통한 항산화 활성 정 도를 질소 비료의 형태에 따라 비교한 결과 꿀풀 잎의 경우 NH4-N 처리구에서 높은 결과를 나타냈으며, NO3-N 처리에서 가장 낮았 고, 섬초롱꽃의 잎 추출물에서는 유의적인 차이를 보이지 않았다 (Table 5). 꿀풀과 섬초롱꽃 뿌리의 항산화 활성은 두 식물체 모두 NH4-N 처리구에서 높게 나타나 앞서 조사한 플라보노이드와 총폴 리페놀 함량과 유사한 경향을 나타내었다. NO 소거활성은 NO가 sulfanilamide와 반응하여 복합체를 형성하고 이와 NED가 반응 하여 520-550nm 범위에서의 흡수도를 가진 Azo 화합물을 형성하 는 반응을 이용하여 측정하였는데(Kang, 2011), 아질산염은 아민 과 반응하여 독성물질로 알려진 nitrosamine을 생성하며, 일정농 도 이상 섭취하게 되면 혈액중의 헤모글로빈이 산화되어 메트 헤모 글로빈을 형성하여 각종 질병을 일으키는 것으로 알려져 이에 대한 생성 억제 방법이 모색되고 있다(Cho et al., 2008). 본 실험에서는 꿀풀과 섬초롱꽃의 NO 소거능은 NH4-N 처리구에서 높게 나타났 다. 즉, NH4-N 처리는 NO 소거능 뿐만 아니라 앞서 살펴본 DPPH 라디칼 소거에 효과적이었고, 이러한 효과는 폴리페놀 함량과 일관 된 경향을 보여 주고 있다. 한편 그러나 보리의 항산화시스템을 연 구한 Ali et al(2013)는 질소형태와 Cr 독성을 연구한 결과 Ca(NO3)2 처리는 (NH4)2SO4처리에 비해 Cr에 의한 산화 스트레 스를 완화시키고, SOD, POD 등의 항산화효소의 활성 증가와 ascorbate 등의 비효소적 항산화제 함량 증가가 일어났다고 하였 다. 본 실험 결과 꿀풀과 섬초롱꽃은 질소비료 공급형태에 따라 식 물의 생육과 생리적 활성 반응은 다르게 나타났는데, 생육은 NO3-N과 NH4-N 혼합처리구에서 좋았고, NH4-N 처리구에서는 생육이 저조하였으나 항산화활성은 오히려 NH4-N 처리구에서 높 게 나타났다. 이는 생산성 증가를 목적으로 실시하는 다량의 질소 시비는 단백질 함량을 증가시켰으나 항산화 물질의 감소를 일으켜 품질의 저하를 유발했다는 연구(Liu et al., 2010)와 유사한 결과로 작물의 수량뿐 아니라 품질을 고려한 적정 시비 전략이 중요함을 알 수 있다. 즉, 생육이외의 항산화활성 및 항산화물질 등 생리활성 을 고려한다면 NO3-N과 NH4-N 혼합처리 시 NH4-N의 비율 증가 를 고려할 수 있겠다. 또한 유기질 질소시비를 통해 DPPH 라디컬 소 거능이 증가하였다는 보고(Montalba et al., 2010)를 참고할 때 추 후 적정한 질소 형태 및 농도에 대한 연구가 필요할 것으로 보인다.
IV. 적요
국내 자생식물인 꿀풀(Prunella vulgaris)과 섬초롱꽃(Campanula takesimana)을 이용하여 질소비료의 형태에 따라 생육반응, 항산 화 물질 함량 및 항산화 활성을 조사하였다. 질소비료처리는 NO3-N 처리구와 NH4-N 처리구 및 이들의 혼용구로 구분하여 수 경재배를 실시하였다. 꿀풀과 섬초롱꽃의 생육은 NO3-N과 NH4-N 혼합처리구에서 좋았다. 총 플라보노이드 함량은 꿀풀의 경우 NO3-N과 NH4-N 혼합처리구가 좋았다. 총 폴리페놀 함량과 DPPH 라디칼 소거능 및 NO 소거 활성 등의 항산화 활성은 NH4-N 처리 구에서 높게 나타났다. NO3-N 처리구의 경우 총 플라보노이드 및 총 폴리페놀 함량이 낮고, 항산화 활성도 낮은 경향이었다.